[ 013 ] プレMAFⓇ療法 (Precursor Macrophage Activating Factor)

概要説明
プレMAFⓇ療法とは?
————————-
プレMAFⓇ療法は、自分自身が持っている糖タンパク質で、身体本来の自然免疫機能を向上させ、がんなどの病気に対応する治療法で、患者様毎に製造を行う為、個々に合わせたオーダーメイド型となります。
プレMAFⓇ療法で用いる糖タンパク質「プレMAFⓇ」は、森田薬品工業(株)の2つの特許技術を用いて、血清中に100種類以上含まれている糖タンパク質の中から純度90%以上で加工・精製しております。
*特許第 5701587 号(ビタミン D 結合タンパク質に特異的に結合するタンパク質)
*特許第 5860401 号(新規 Gc グロブリンガラクトース脱糖体の製造方法)
プレMAF療法の4つの特徴

1、免疫機能の向上
体内の異物を直接捕食するマクロファージを活発にし、免疫力を上げることを目指します。
2、副作用が少ない
患者様自身の血清が元のため、身体的負担を最小限に留めることができます。
3、他の治療法との併用が可能
体内で生成される成分を使用するため、他の治療と併用しての施術が可能です。
4、他の免疫療法に比べて安価
他の治療と併用しやすいよう、患者様の経済的な負担を少なくしています。
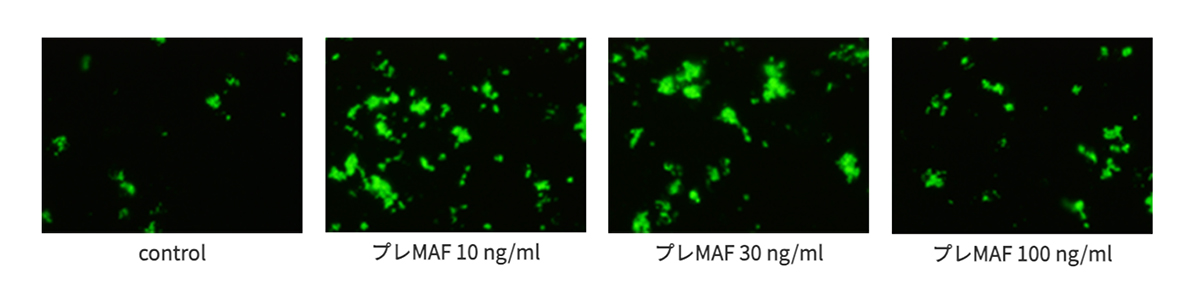
ヒトPBMC付着細胞分画の貪食能評価 (東京慈恵会医科大学との共同研究結果)
<試験方法>
健常成人ボランティアよりヘパリン採血で末梢血を約20ml採取した。
Ficoll density gradient centrifugation法を用いてPBMCを採取し、無血清RPMI-1640培地に細胞を浮遊させ10cm Petri Dishに植え込んだ。
プレMAF (PBMCの由来した同一健常ボランティアのGcよ り作製)、または、コントロールのPBSをPBMC培養の培地に添加し4時間培養した。
その後、温PBSで細胞を洗浄し、浮遊細胞と培地を除いた。
培養した付着細胞分画の貪食能をPhagocytosis Assay Kit (IgG FITC, Cayman) を用いて、 IgGでcoatingされた蛍光ビーズを付着細胞に加え90分間培養した。
洗浄後、蛍光顕微鏡によ りランダムに10視野を撮影した。
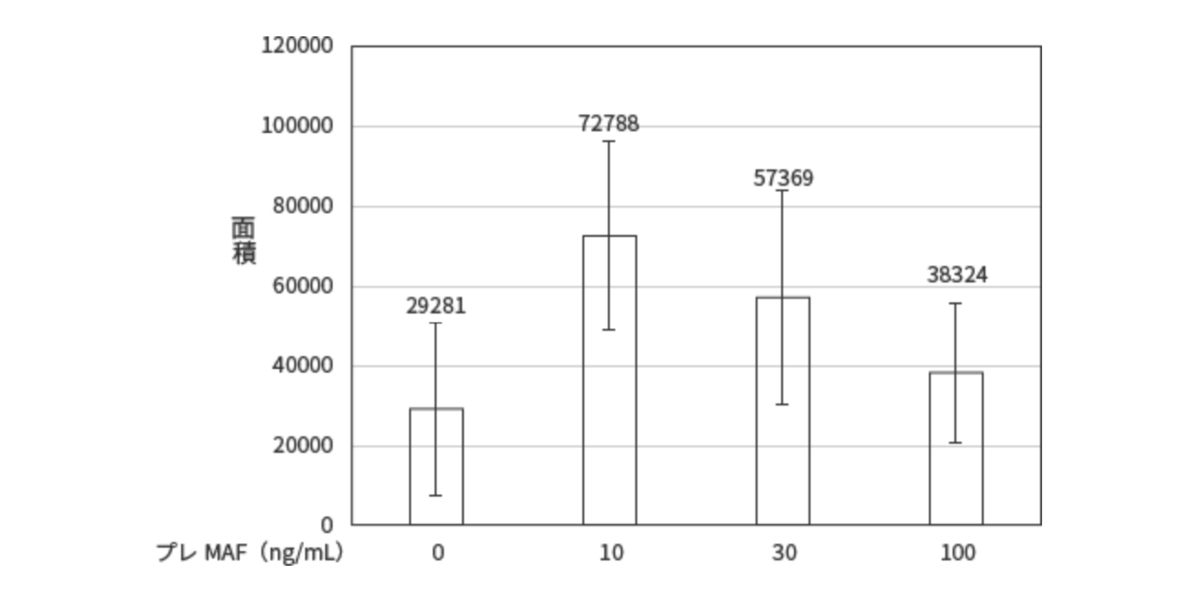
蛍光顕微鏡写真をWinROOFを用いて解析し、写真に占め る蛍光の面積絶対値を求めマクロファージの貪食能として評価した。
<試験結果>
ヒトPBMC付着細胞分画はプレMAF処理により明らかな貪食能の増加が認められ、10ng/mlのプレMAFで最も強い貪食能の増加が認められた。
マウス肺がんに対する抗腫瘍評価試験 (東京理科大学との共同研究結果)
<試験方法>
Lewis Lung Carcinoma (LLC) 細胞は、100mmプラスチックシャーレにおいて、10%ウシ胎児血清含有Dulbecco’s Modified Eagle Mediumにより37°C、5% CO2 のもと培養した.
培養上清を除き、LLC細胞を4°CのPhosphate Buffered Saline (PBS) に懸濁させ、4°Cのもと200×gで5分間遠心し、 さらに上清を除いた.
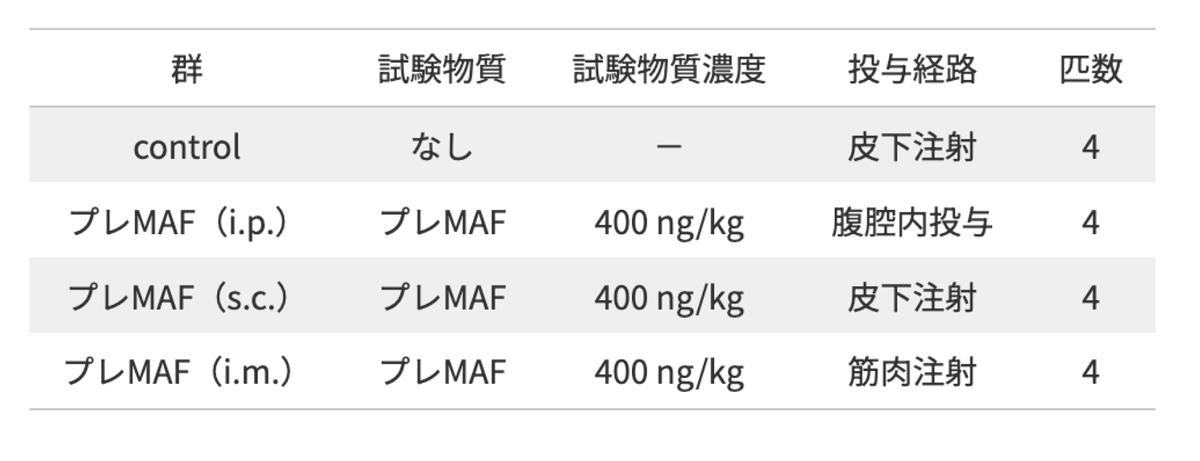
沈殿したLLC細胞を4°CのPBSに懸濁させ、2×105 cellsのLLC細胞を1群4匹から成る6週齢のC57BL/6マウス(雄)の尾静脈内から注射した.
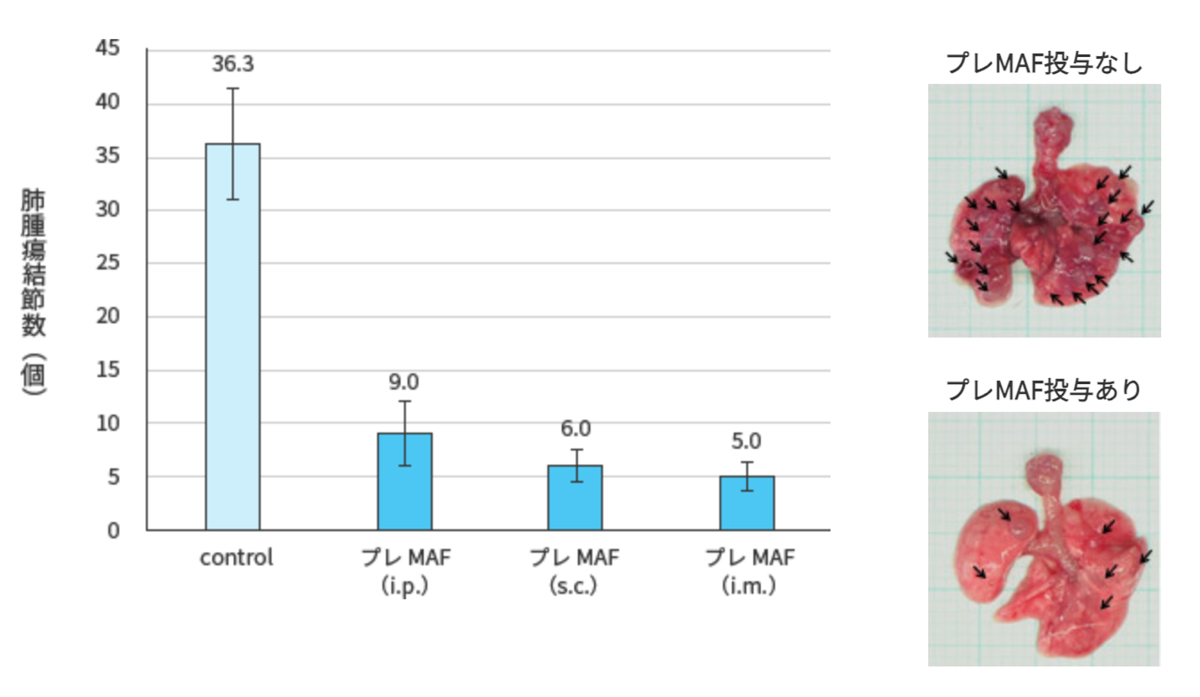
注射7日後から400ng/kgのプレMAFを、腹腔内投与 (i.p.)、皮下注射(s.c.)、筋肉注射 (i.m.)にて10日間連続投与した.
最終投与翌日にマウスを屠殺し、肺を実態顕微鏡により撮影の上、肺に形成された腫瘍結節数を計測した.
<試験結果>
プレMAFはどの投与経路においても、肺に出来た腫瘍数が著しく減少している事が分かります。
つまり、プレMAFには抗腫瘍効果がある事を示している。
マウス腹腔マクロファージを用いた貪食活性経時変化評価試験 (徳島大学との共同研究結果)
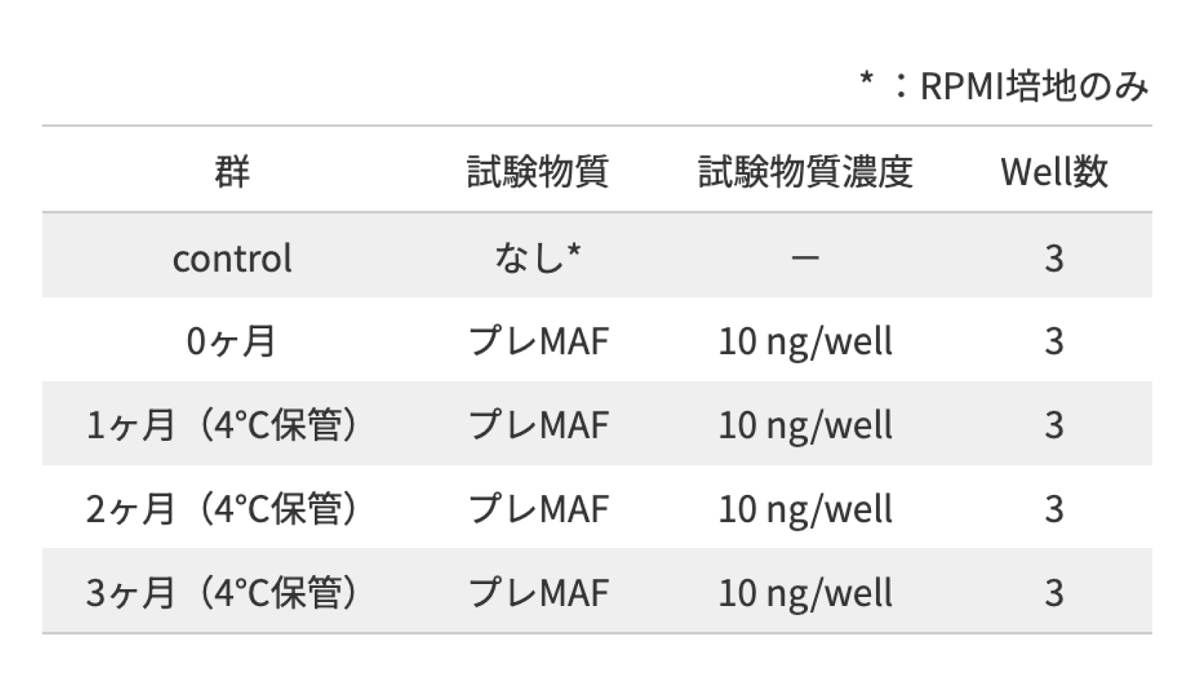
<試験方法>
ICRマウス (♀ 8 weeks) を頸椎脱臼し、マウス腹腔マクロファージを回収した.
回収後、Burker-Turk型血球計算版にて1.0×106cells/mLに調整した.
24穴プレートに滅菌したカバーガラスを入れ、採取調整した腹腔内細胞液を5.0×105 cells/well分注の上、 カバーガラスにマクロファージを定着 (37°C・1h)させた.
定着後、腹腔内細胞液をエッペンチューブに回収し、サンプル(プレMAF)及び比較として RPMI培地(control)を加え、反応させた (37°C・1h).
定着させたカバーガラスは、RPMI培地にて洗浄の上、インキュベート (37°C・15h) を行った.
インキュベート後、腹腔液処理サンプルをそれぞれ添加し、マクロファージを刺激 (37°C・3h)し、 0.5%オプソニン化SRBCを加え、貪食させた (37°C・1.5h) 貪食後、洗浄の上、ギムザ染色し、 顕微鏡にて検鏡を行った.
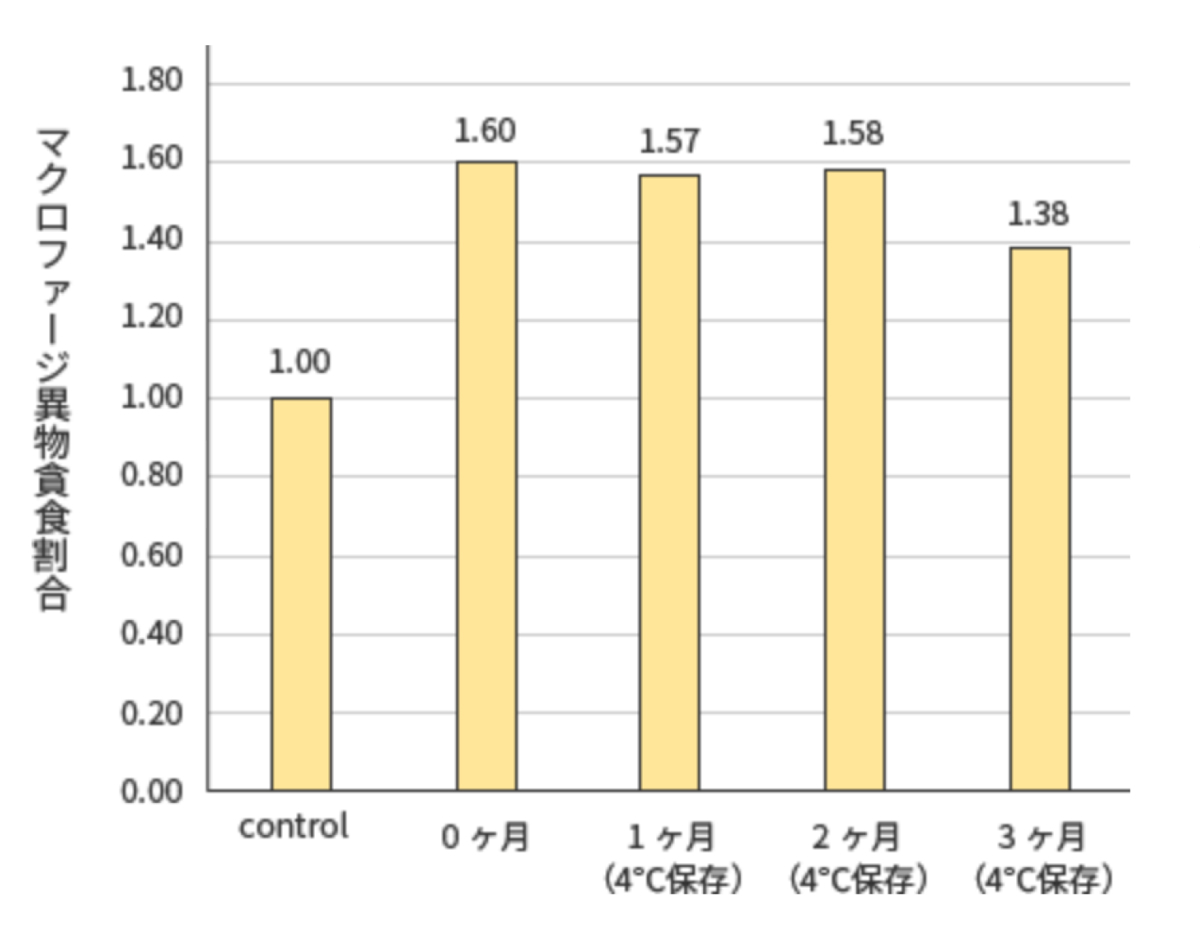
<試験結果>
プレMAFは冷蔵保管3ヶ月でもマクロファージを活性化することが示唆された。
抗体製剤との併用効果評価試験 (東京慈恵会医科大学との共同研究結果)

<試験方法>
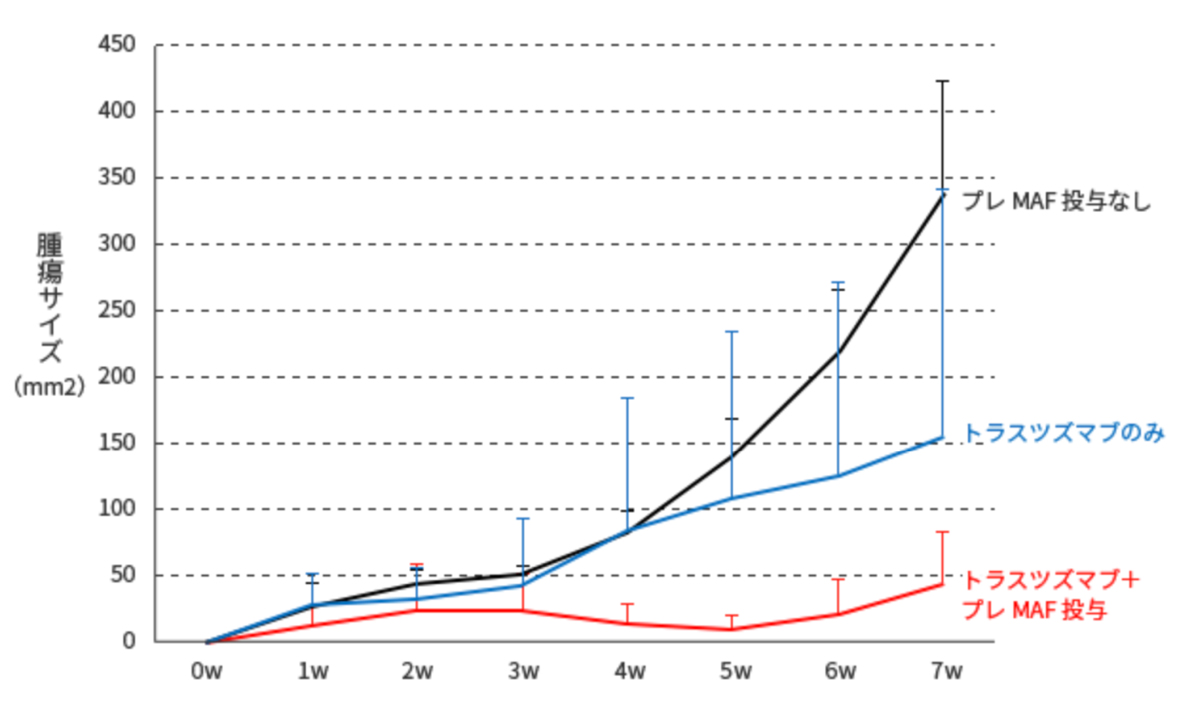
ヌードマウスの背部皮下に106/mouseのOE19細胞を移植した。 マウスを4群に分け、無処置群、プレMAF, トラスツズマブ単独、または併用投与群とした。
プレMAFは10ng/mouseを移植後5日目より10日間連続で皮下注射した。
トラスツズマブは25μg/mouseを移植後5日目より3日間間隔で計4回腹腔内に投与した。
腫瘍細胞を移植後、週1回の頻度で腫瘍径を垂直に交わる2方向からキャリパーを用いて計測し、 その数字を乗じたものを腫瘍サイズ (mm2)として表した。
<試験結果>
抗体製剤(トラスツズマブ) 単独群より、プレMAFとの併用群の方が腫瘍サイズが著しく 小さくなっている事が分かります。
つまり、プレMAFには抗体製剤との併用による抗腫瘍効果がある事を示している。
トラスツズマブとはHER2蛋白に特異的に結合する事で抗腫瘍効果を発揮する分子標的治療薬の一種。
HER2に特異的に結合した後、NK細胞、単球を作用細胞とした抗体依存性細胞傷害作用 (ADCC)により抗腫瘍効果を発揮する。
血管新生阻害活性評価試験 (ジーン・ステム(株)への委託結果)

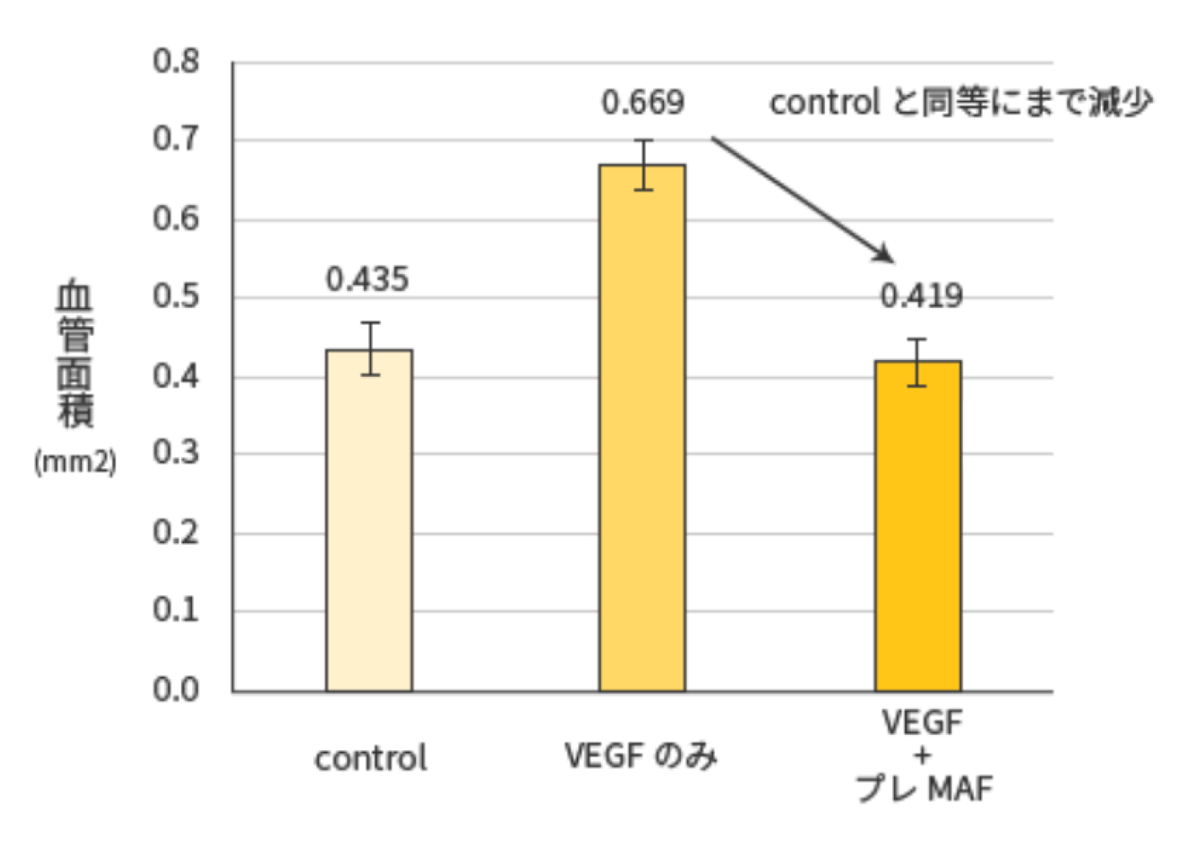
<試験方法>
48 well plate Matrigelを200μL/wellコーティングし、HUVECを1万細胞/200μL/wellにて培養した。
培養にはHuMedia-EB2にFCSを1%濃度で加えたMediumを用いた.
Mediumにはrecombinant human VEGF165(hVEGF165)を10ng/mlの最終濃度になるように添加し、 加えて試験物質を添加した (下記表を参照) 培養開始から12~16時間後に写真を撮影し、 形成されたtubeの長さ、分岐点を定量化した.
測定結果はOMS社の統計解析ソフト「Statcel2」を用いて、全ての群間の比較を一元配置分散分析法(ANOVA)とTukey-Kramer法により有意差があるかどうかを検定した.
<試験結果>
プレMAF投与により、血管新生が抑制されている事が分かります。
つまり、プレMAFにはがん細胞に 酸素・栄養素を供給する経路となる血管の増殖が抑えられている事を示している。
-
血管新生とは?
がん細胞は、自身が成長する為に必要な酸素や栄養を得る為に、新しい血管を形成しようと働く。
この、新しい血管が形成されることを「血管新生」と呼ばれている。
この新生された血管は、がん細胞への酸素や栄養の供給を行うだけでなく、がん転移の経路も果たしているとも考えれらている。
-
VEGFとは
血管内皮細胞増殖因子(vascular endothelial growth factor) の略。
血管新生に関与する一群の糖タンパク質であり、VEGFの過剰発現は腫瘍の血管増生や転移と関連している事が報告されている。
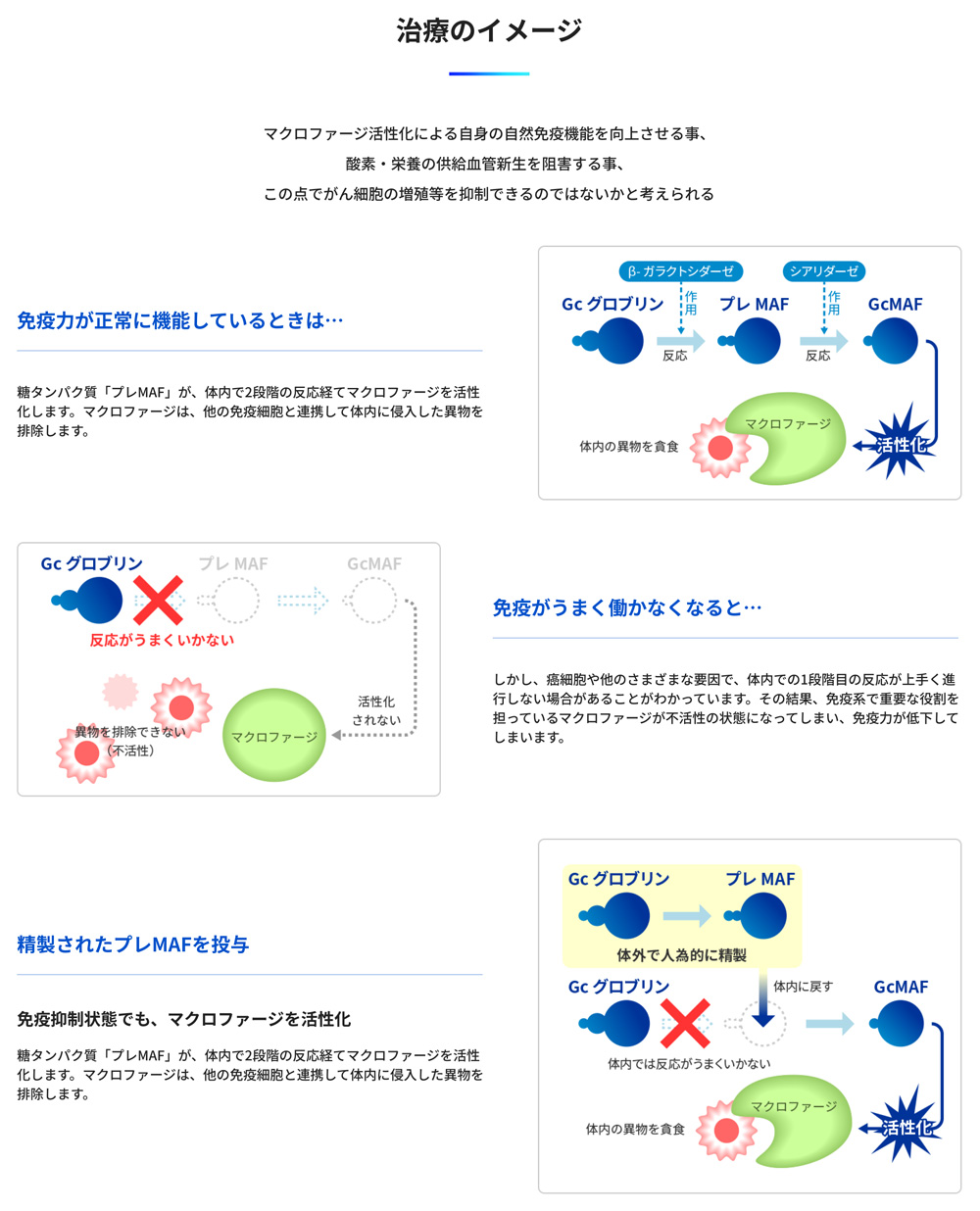
マクロファージ活性化による自身の自然免疫機能を向上させる事、酸素・栄養の供給血管新生を阻害する事、 この2点でがん細胞の増殖等を抑制できるのではないかと考えられる。
マウス腹腔マクロファージを用いた 貪食活性評価試験 (徳島大学との共同研究結果)
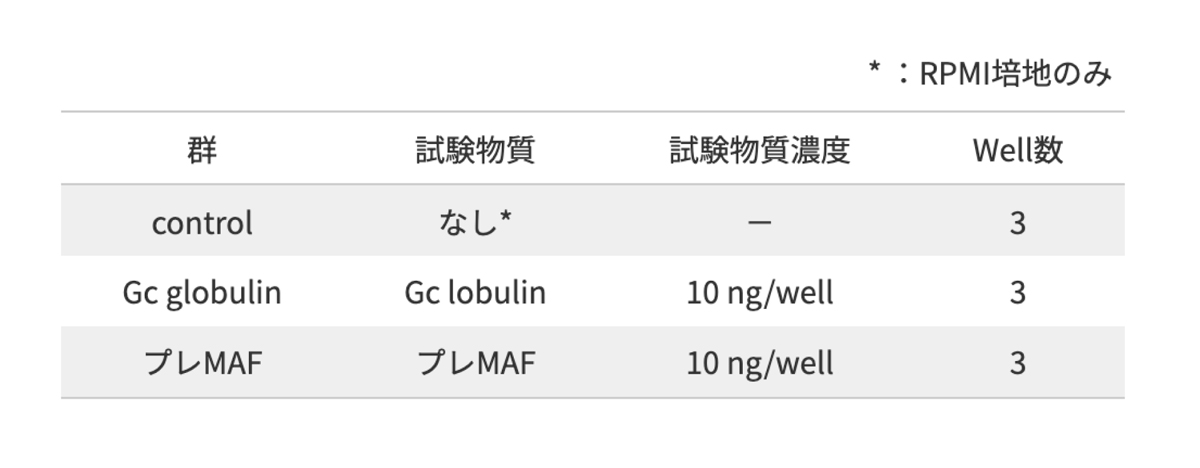
<試験方法>
ICRマウス (♀、8 weeks) を頸椎脱臼し、マウス腹腔マクロファージを回収した.
回収後、Burker-Turk型血球計算版にて1.0 × 10°cells/mLに調整した.
24穴プレートに滅菌したカバーガラスを入れ、採取調整した腹腔内細胞液を5.0×105cells/well分注の上、 カバーガラスにマクロファージを定着 (37°C・1h)させた.
定着後、腹腔内細胞液をエッペンチューブに回収し、サンプル (Gc globulin, プレMAF) 及び比較としてRPMI培地(control) を加え、反応させた(37°C・1h).
定着させたカバーガラスは、RPMI培地にて洗浄の上、インキュベート (37°C・15h) を行った.
インキュベート後、腹腔液処理サンプルをそれぞれ添加し、マクロファージを刺激(37°C・3h)し、0.5%オプソニン化SRBCを加え、貪食させた (37°C・1.5h) 貪食後、洗浄の上、ギムザ染色し、顕微鏡にて検鏡を行った.
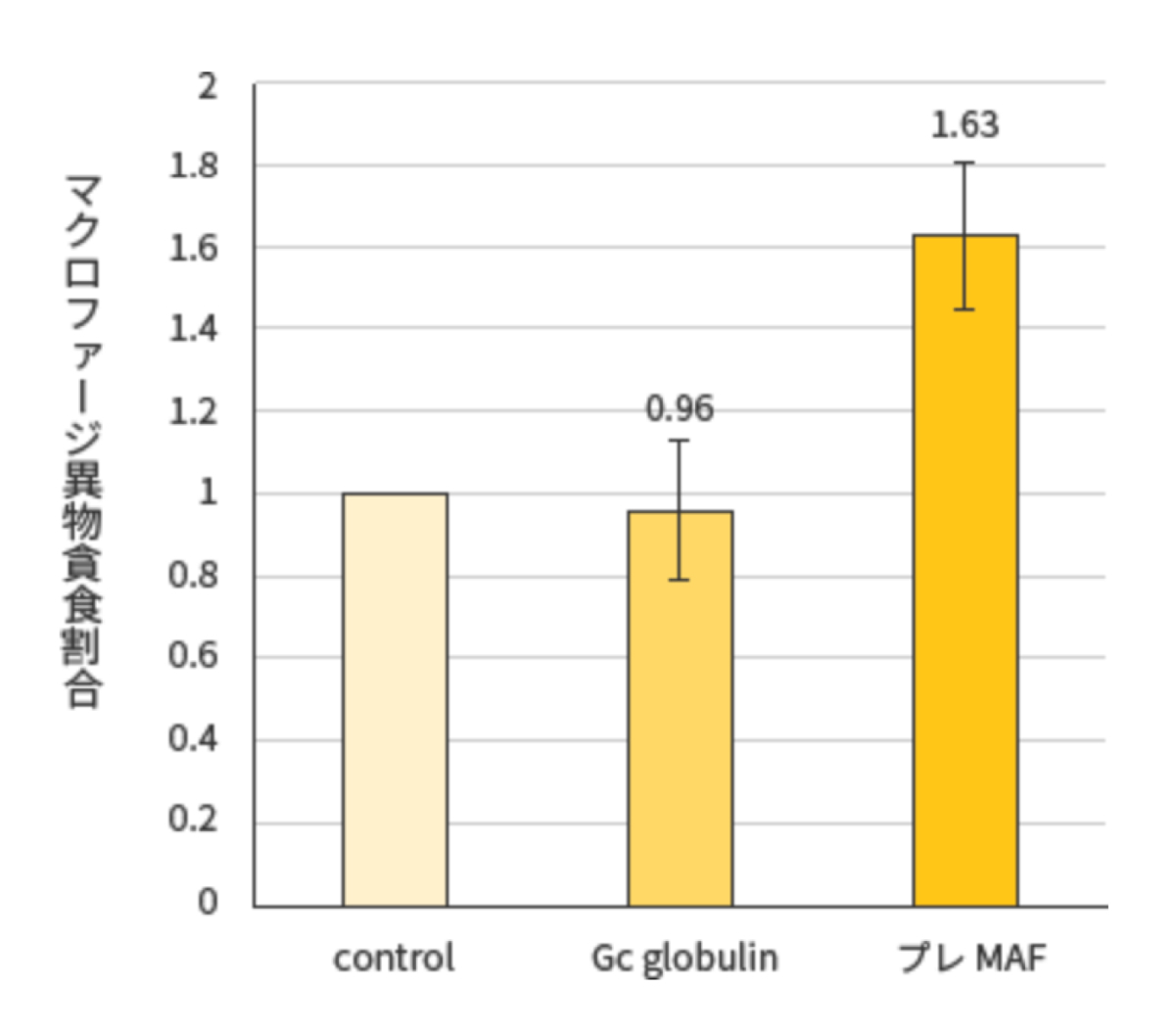
<試験結果>
プレMAFの投与により、免疫細胞の1つであるマクロファージが活性化させる事、 Gc globulinだと活性化されない事を示している。 Gc globulinからプレMAFへの変換は必要であることが示唆された。
毒性評価試験(株)DIMS医科学研究所への委託結果
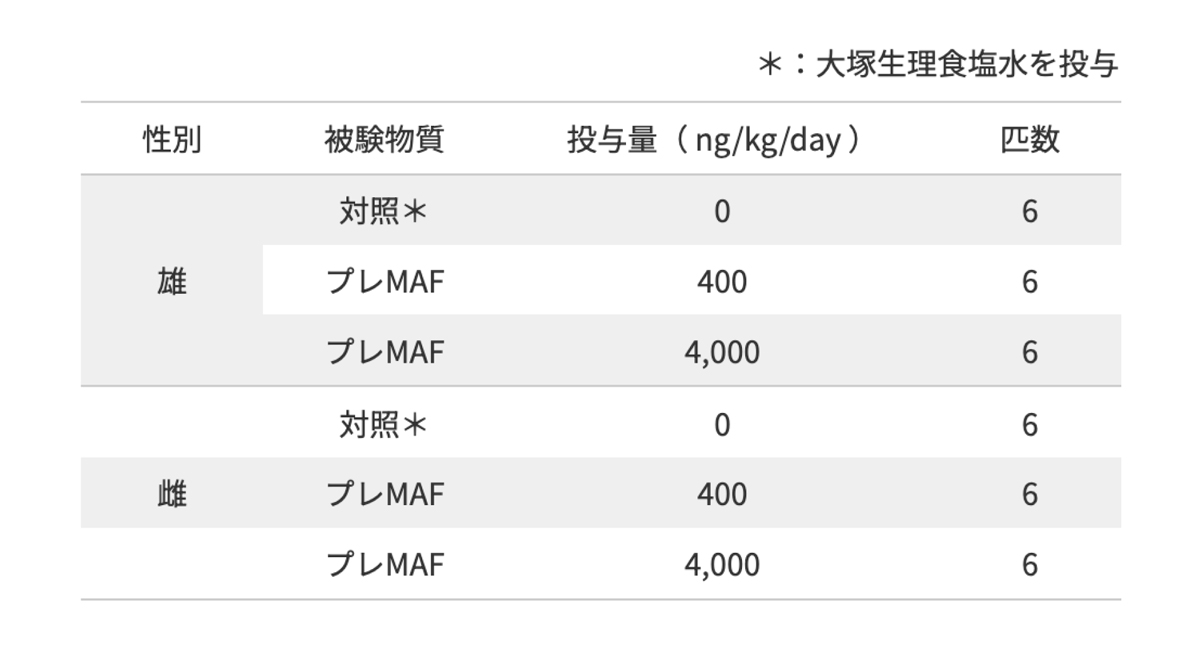
<試験方法>
6週齢 Crl:CD (SD)系ラットを体重層別法により、雌雄ともに6匹/群×3群に群分け。
群分け後、プレMAFを週1回、13週間間歇皮下投与し、間歇皮下投与による毒性影響を検討した。
<試験結果>
雌雄ともに、プレMAF (4,000ng/kg/day) を13週間連続にて投与したマウスの死亡は認められず、異常は認められなかった。
これは、プレMAFの無毒性量(NOAEL)は、4,000ng/kg/day (240μg/60kg/day)以上である事を示している。
治療の流れ
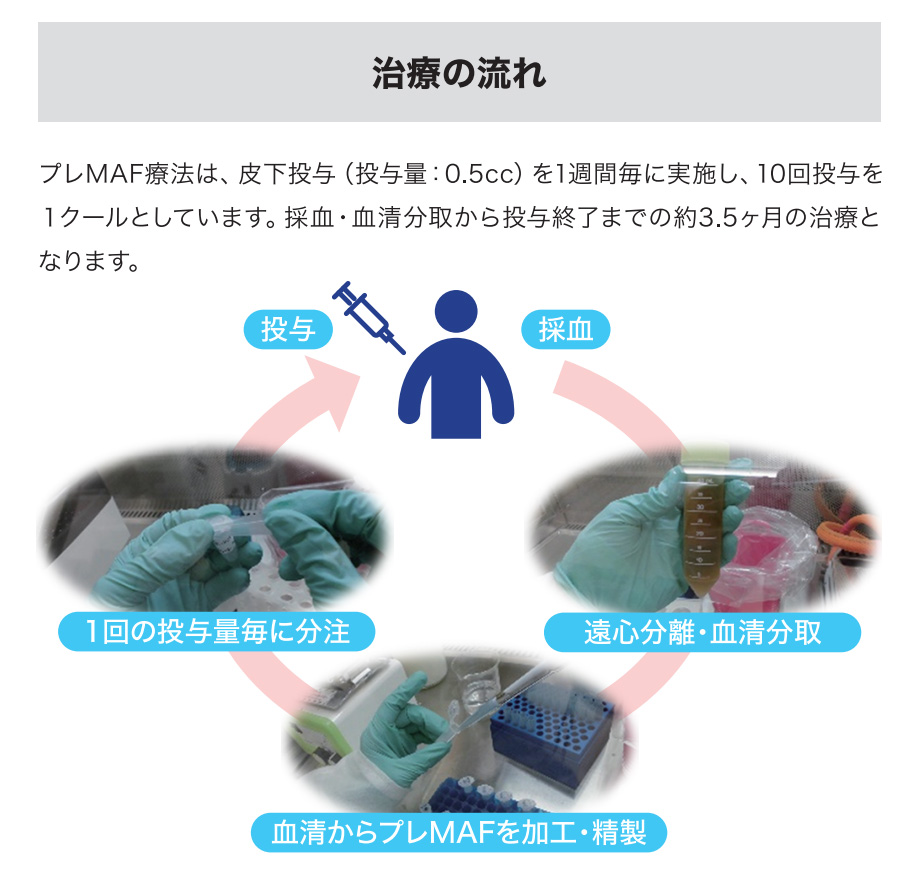
患者様御本人の血液を採取し、酵素処理の過程を経て、プレMAFⓇを精製した後、皮下投与することで、マクロファージ本来の貪食活性を高める治療法です。
プレMAF療法は、皮下投与(投与量:0.5cc)を1週間毎に10回投与を1クールとして実施します。1クールでおよそ3.5ヶ月となります。
自己血清糖タンパク質を用いた免疫療法である「プレMAFⓇ療法」を行うことで、マクロファージを活性化させ、自然免疫機能の向上につながり、マクロファージ本来の貪食活性を高める治療になります。
患者様本人の血液を処理
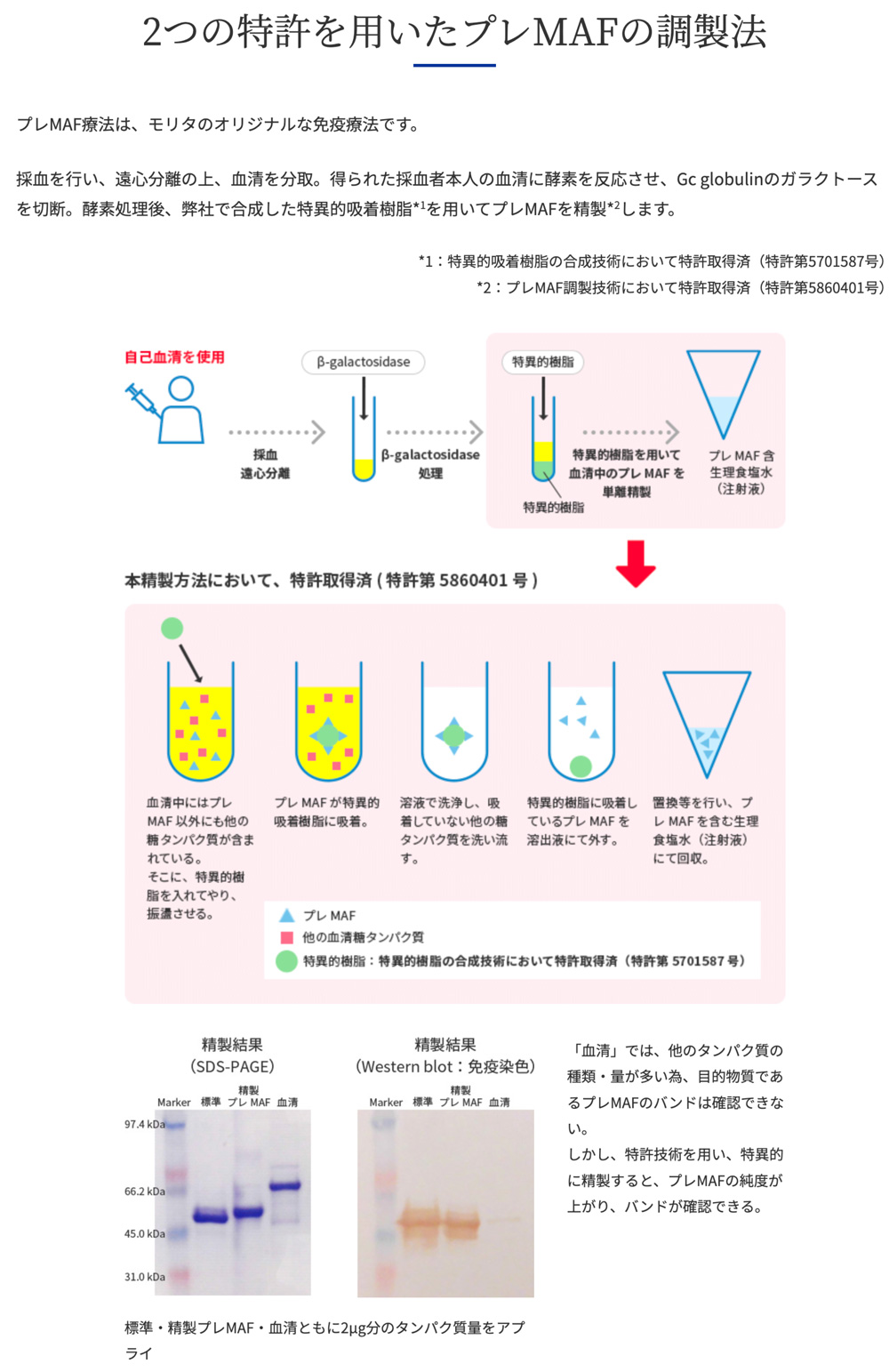
採血を行い、遠心分離の上、血清を分取。得られた採血者本人の血清を酵素処理(加工)します。その後、弊社で合成した特異的吸着樹脂*1を用いてプレMAFⓇを精製*2します。
*1:特異的吸着樹脂の合成技術において特許取得済(特許第5701587号)
*2:プレMAF調製技術において特許取得済(特許第5860401号)
治療による副反応
報告なし
備考
論文
マクロファージ活性化1), 2)
1) Effect of the Gc-derived Macrophage-activating Factor Precursor (preGcMAF) on Phagocytic Activation of Mouse Peritoneal Macrophages. Anticancer Res., 31, 2489-2492, 2011
2) β-Galactosidase Treatment Is a Common First-stage Modification of the Three Major Subtypes of Gc Protein to GcMAF. Anticancer Res.,32, 2359-2364, 2012
血管新生阻害活性3)
3) https://moritamedical.jp/premaf/experiment_04.html
抗腫瘍活性4)
4) Antitumor Effect of Degalactosylated Gc-globulin on Orthotopic Grafted Lung Cancer in Mice. Anticancer Res., 33, 2911-2916, 2013






